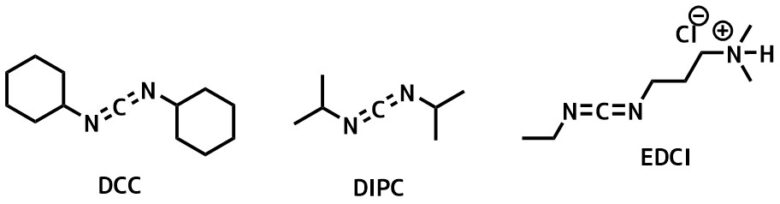
1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(英語: 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide, EDC, EDAC, EDCI)は、通常、塩酸塩の形で使われる水溶性のカルボジイミドである 。
通常、pH 4.0 ~ 6.0の範囲で使用される。一般に、一級アミンをカップリングしてアミド結合を得るためのカルボキシル活性化剤として使用される。この目的には、N,N′-ジシクロヘキシルカルボジイミド (DCC) やN,N′-ジイソプロピルカルボジイミド (DIC) など他のカルボジイミドも用いられるが、EDCでは尿素副生成物(DCCやDICの場合、除去が困難なことが多い)を希酸を用いてアミド生成物から洗い流すことができるという利点がある。さらに、EDCはホスホモノエステルやホスホジエステルを形成するためにリン酸基を活性化するのにも使用できる。このカルボジイミドの一般的な用途には、ペプチド合成、核酸へのタンパク質架橋などがあるが、免疫複合体の合成にも使われる。EDCはしばしば、N-ヒドロキシコハク酸イミド (NHS) と組み合わせて大きな生体物質の固定化に用いられる。最近の研究では、RNA中の核酸塩基ウラシルの構造状態の評価にEDCが使われている。
合成
EDCは市販されている。イソシアン酸エチルをN,N-ジメチルプロパン-1,3-ジアミンにカップリングさせ尿素とし、これを脱水することで合成できる。
メカニズム
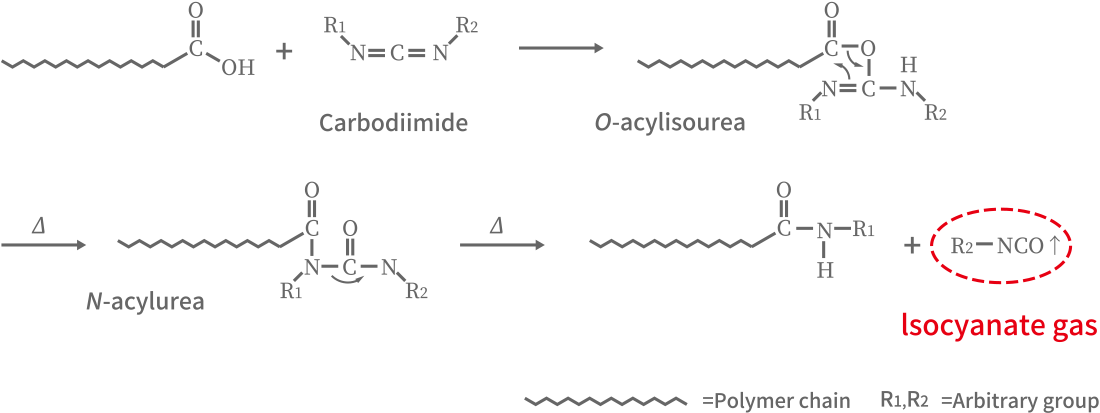
EDCは、活性化されたエステル脱離基を作ることで、第一級アミンやその他の求核剤をカルボン酸に結合させる。まず、酸のカルボニルがEDCのカルボジイミドを攻撃し、それに続いてプロトンが移動する。その後、一級アミンが酸のカルボニル炭素を攻撃し、四面体型中間体を形成した後、分解して尿素の副生成物を放出する。目的のアミドが得られる。
安全性
OECD 429に従ったin vivo経皮感作性試験では、EDCが強い皮膚感作性物質であることが確認され、局所リンパ節アッセイ法 (LLNA) では0.01 wt%未満で反応を示し、化学品の分類および表示に関する世界調和システム(GHS)の経皮感作性カテゴリー1Aに分類された。示差走査熱量測定 (DSC) による分析では、EDCの爆発性が最小であることが示された。
出典
参考文献
- López-Alonso, JP; Diez-Garcia, F; Font, J; Ribó, M; Vilanova, M; Scholtz, JM; González, C; Vottariello, F et al. (2009). “Carbodiimide EDC Induces Cross-Links That Stabilize RNase A C-dimer against Dissociation: EDC Adducts Can Affect Protein Net Charge, Conformation and Activity”. Bioconjugate Chemistry 20 (8): 1459–1473. doi:10.1021/bc9001486. PMID 19606852.
- Nakajima, N; Ikada, Y (1995). “Mechanism of Amide Formation by Carbodiimide for Bioconjugation in Aqueous Media”. Bioconjugate Chemistry 6 (1): 123–130. doi:10.1021/bc00031a015. PMID 7711098.

![88992910・3{[2(Acryloyloxy)ethyl]dimethylammonio}propane1sulfonate](https://labchem-wako.fujifilm.com/sc/05/013-28492.png)
